Enlaces químicos

En esta ingenioactividad, teníamos que hablar e investigar acerca de los enlaces químicos. Hay dos tipos de enlaces: enlace iónico y enlace covalente.
Enlace iónico: en este enlace, un átomo pierde electrones de su último orbital al donárselos a otro átomo, acabando con carga positiva y transformándose en catión, mientras que el otro recibe electrones y acaba con carga positiva transformándose en anión.
Enlace covalente: este enlace se produce entre átomos de un mismo elemento no metal, y entre distintos elementos no metálicos. En este, se pueden compartir uno o más electrones situados en el último orbital de los átomos que realizan el enlace.
En nuestro grupo, tuvimos un enlace iónico y otro covalente. El iónico era el de KCl, y el covalente era el de Br2.
Enlace iónico
KCl:
Supimos que este enlace era iónico, debido a que potasio es un no elemento metálico, y cloro no lo es.
El número atómico de potasio era z=19, por lo que su configuración electrónica era:
1s2 2s2 2p6 3s2 3p6 4s1
 El número atómico de cloro era z=17, por lo que su configuración electrónica era:
El número atómico de cloro era z=17, por lo que su configuración electrónica era:
1s2 2s2 2p6 3s2 3p5
 A potasio le sobra un electrón en su último orbital, mientras que a cloro aún le falta un electrón para completar su tercera órbita. Al ser un enlace iónico, el átomo de potasio donara a cloro su electrón sobrante, quedándose el con un electrón menos, con una órbita menos y con carga positiva, por lo que ahora se llama: catión de potasio, K+. Su configuración electrónica también ha cambiado, por lo que ahora es así: 1s2 2s2 2p6 3s2 3p6.
A potasio le sobra un electrón en su último orbital, mientras que a cloro aún le falta un electrón para completar su tercera órbita. Al ser un enlace iónico, el átomo de potasio donara a cloro su electrón sobrante, quedándose el con un electrón menos, con una órbita menos y con carga positiva, por lo que ahora se llama: catión de potasio, K+. Su configuración electrónica también ha cambiado, por lo que ahora es así: 1s2 2s2 2p6 3s2 3p6.
Al átomo de cloro le falta un electrón para completar su último orbital. En este enlace, cloro ha recibido un electrón y ha completado su último orbital, que tiene ahora ocho electrones. Al haber recibido un electrón, ha pasado a tener carga negativa, por lo que ahora se llama anión de cloro, Cl-. Igual que en el caso del átomo de potasio, su configuración electrónica también ha cambiado, y ahora es así: 1s2 2s2 2p6 3s2 3p6
Y quedaría así:

Enlace covalente
Nada mas verlo, supimos que Br2 era un enlace covalente debido a que estamos mezclando dos átomos de un mismo elemento no metálico.
Bromo tiene de número atómico z=35, por lo que su configuración electrónica es:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
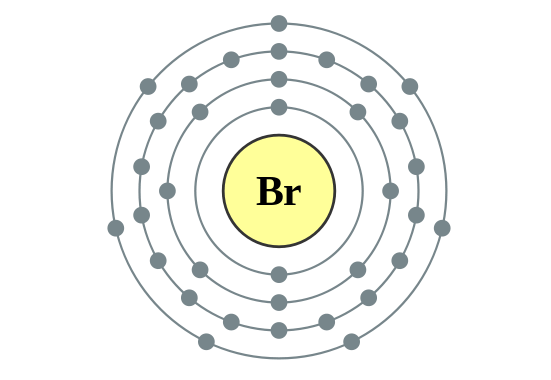
Al átomo de bromo le falta un electrón en su último orbital para completarlo. Tiene siete electrones, cuando podría tener ocho. Al ser dos átomos de bromo, al otro átomo le ocurre lo mismo. Al ser un enlace covalente, estos dos átomos van a conectar sus últimos orbitales, para compartir electrones. Si cada átomo de bromo comparte un electrón, se completarán los orbitales de ambos átomos, quedando así:

Al haber conseguido cada átomo de bromo un electrón, cambia la configuración electrónica de ambos quedándose en: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Presentación
Hicimos un prezi que contenía la información de este trabajo, este es el link:
http://prezi.com/1404sm4hh3rp/?utm_campaign=share&utm_medium=copy
Reflexión
En este trabajo, iba con María, Victoria y Ana María. Creo que todas trabajamos lo mismo, y todas aportamos información y conocimientos y todas participamos en la cartulina. Este trabajo me ha servido de mucho para aprender más acerca de los átomos y los enlaces. Al hacer este trabajo, he podido representar los enlaces y los átomos, por lo que ya lo entiendo mucho mejor, y tengo mucha más práctica. Este trabajo también me ha ayudado mucho a saber como colocar los electrones, cuantos caben en cada órbita, y sus configuraciones electrónicas. Me ha gustado bastante este trabajo, ya que me encanta representar lo que aprendemos en clase. Sin embargo, me ha gustado más el enlace covalente, porque cuantos más electrones haya que poner en las órbitas, más hay que dibujar, y más hay que calcular.
-Ana López Torreblanca
3ºESO B
Física y química